ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ - простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в нем. Это число является фундаментальным свойством элемента и называется атомным номером, так как совпадает с порядковым номером элемента в периодической системе элементов, открытой в 1869 русским химиком Д.И.Менделеевым. Например, все атомы, содержащие 2 протона в ядре (все атомы с атомным номером 2) являются атомами гелия, они составляют элемент гелий. Все атомы, содержащие 92 протона в ядре, являются атомами урана и составляют элемент уран. Каждый элемент обозначается символом из одной или двух латинских букв названия элемента (например, He для гелия, U для урана) или его атомным номером. (Алфавитный список элементов дан в статье ХИМИЯ.) Кроме протонов атомное ядро обычно содержит нейтроны. Для данного элемента число протонов неизменно, а число нейтронов может меняться. Атомы элемента с различным количеством нейтронов называются изотопами данного элемента. Атом содержит столько же электронов, сколько и протонов, электронные орбитали вокруг ядра располагаются на квантовых уровнях, или слоях. Химические свойства элемента в значительной степени определяются числом электронов на внешнем электронном слое (внешней оболочке), а поскольку все атомы элемента имеют одно и то же число электронов на внешнем слое, то все они имеют одинаковые химические свойства. Физические свойства могут изменяться от изотопа к изотопу. Когда элементы расположены в порядке возрастания атомного номера, элементы со сходными свойствами периодически повторяются. Эта периодичность в свойствах становится весьма очевидной, когда элементы располагают как показано в периодической таблице (рис. 1), где элементы со сходными свойствами расположены в вертикальных колонках, называемых группами (подгруппами) или семействами
(см. также ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ).
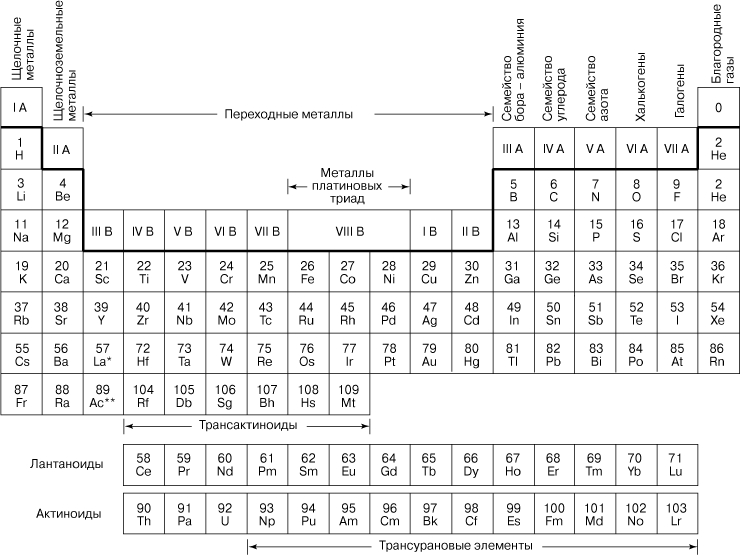
Рис. 1. ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ
Из известных химических элементов в природе существуют элементы с атомным номером от 1 до 92; исключение составляют технеций (ат. номер 43) и прометий (ат. номер 61), которые получены искусственно путем ядерных реакций. Все трансурановые элементы с атомными номерами от 93 также получены искусственно. В космосе наиболее распространены водород и гелий. На Земле два десятка элементов составляют в основном массу земной коры: O (46,6%), Si (27,7%), Al (8,1%), Fe (5,0%), Ca(3,6%), Na (2,8%), K (2,6%), Mg (2,1%), Ti (0,5%), P (0,2%), H (0,14%), Mn (0,1%), S (0,05%), F (0,05%), Cl (0,03%), Sr (0,03%), C (0,03), Ba (0,02%), Cr (0,02%), а на все остальные элементы приходится чуть больше 0,3% (масс.).
Химические элементы существуют в виде простых веществ, состоящих из атомов одного элемента, и в виде химических соединений, состоящих из атомов разных элементов. Например, вода это соединение водорода и кислорода. Свойства соединения отличаются от свойств образовавших его элементов; так, водород и кислород имеют четко выраженные отличные от свойств воды свойства. В химических реакциях атомы стремятся к взаимодействию, чтобы перейти в более устойчивое состояние, удерживая на внешних электронных оболочках максимально возможное число электронов; происходит это в результате перемещения или спаривания электронов. (Химические реакции, строение атома, строение электронных оболочек наиболее полно изложены в статье ХИМИЯ.) См. далее
ЖЕЛЕЗА ТРИАДЫ И ПЛАТИНОВЫХ МЕТАЛЛОВ
ЛИТЕРАТУРА
Трифонов Д.Н. и др. Химические элементы и нуклиды. М., 1980 Популярная библиотека химических элементов, кн. 12. М., 1983 Эмсли Дж. Элементы. М., 1993